تاشدگی پروتئین فرایندی فیزیکی است که در آن بس پپتید ( یا پلی پپتید ) به ساختار سه بعدی طبیعی خاص خود درمی آید. این ساختار غالباً دارای عملکرد زیستی است. پروتئین ها از مولکول های اصلی تشکیل دهندۀ سلول ها هستند و به سلول ها شکل و ساختار مشخص می دهند. همچنین، تقریبا تمام کارکردهای سلول از پروتئین ها نشئت می گیرد. در واقع پروتئین ها می توانند کارکردهای بسیار زیاد و متنوعی داشته باشند، که این موضوع نتیجۀ اشکال متنوعی است که پروتئین ها به خود می گیرند. از لحاظ شیمیایی، پروتئین ها پیچیده ترین ساختار و کارکرد را در بین مولکول های شناخته شده دارند. هر پروتئین از یک بس پپتید آغاز می شود. بس پیپیدها هرکدام زنجیره ای از اسیدهای آمینه هستند که در آغاز هیچ ساختار سه بعدی خاص و پایایی ندارند ( سمت چپ شکل روبه رو ) . شکل پروتئین از روی دنباله ی آمینواسیدهای آن تعیین می شود. درنتیجه، برای درک تاشدگی پروتئین باید ابتدا با ساختار آمینواسیدها و پیوندهای بین آن ها آشنا شویم. هر اسیدآمینه در زنجیره می تواند ویژگی های شیمیایی خاصی داشته باشد؛ مثلاً آب دوست ( هیدروفیل ) یا آب گریز ( هیدروفوب ) یا باردار باشد. اسیدهای آمینه به خاطر این ویژگی ها با یکدیگر و با محیط سلول برهم کنش می کنند و سرانجام ساختار سه بعدی ویژه ای را که همان ساختار طبیعی پروتئین است به خود می گیرند ( سمت راست شکل ) . اسیدآمینه های موجود در بس پپتید تعیین کنندۀ ساختار سه بعدی نهایی پروتئین هستند ( قاعدۀ آنفینسن ) . سازوکار تاشدگی پروتئین هنوز به طور کامل شناخته نشده است.
اسیدهای آمینه از یک گروه آمین و یک گروه کربوکسیل و یک زنجیرهٔ جانبی ساخته شده اند و با پیوندهای کوالانسی به هم متصلند. پیوند کوالانسی بین اسیدهای آمینه بسیار محکم است به طوری که امکان جابه جایی و چرخیدن به اتم های N - H و C=O را نمی دهد، اما سایر پیوندها دارای استحکام کمتری بوده و امکان چرخیدن برایشان وجود دارد. این ویژگی باعث می شود پروتئین ها خاصیت انعطاف پذیری پیدا کنند و بتوانند تا بخورند.
پروتیین ها در اثر تاخوردگی شکل فضایی ای را ایجاد می کنند که دارای کمترین انرژی است. وقتی پروتئین تا می خورد پیوندهای ضعیف غیر کوالانسی به تثبیت تا خوردگی کمک می کنند. این پیوندها عبارتند از: پیوند یونی، پیوند هیدروژنی، برهمکنش های واندروالس و نیروهای آب گریز.
همانطور که گفته شد زنجیره جانبی متصل به اسیدهای آمینه می توانند قطبی یا غیرقطبی باشند. وقتی پروتئین در آب سیتوزولی قرار می گیرد زنجیره های جانبی آب گریز تمایل دارند به صورت یک مجموعه در درون مولکول پروتئین قرار بگیرند تا حداقل تماس با مولکول های قطبی آب را داشته باشند و اثر تضعیف کنندۀ آن ها بر پیوندهای هیدروژنی آب حداقل باشد. از طرف دیگر زنجیره های جانبی ای که قطبی هستند تمایل دارند که در روی سطح مولکول پروتئین قرار بگیرند و با مولکول های آب یا سایر مولکول های قطبی پیوند هیدروژنی ایجاد کنند. بنابراین خاصیت آب گریزی زنجیره های جانبی در تعیین شکل پروتئین نقش اساسی دارد.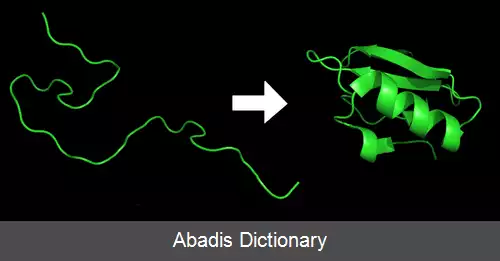
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاسیدهای آمینه از یک گروه آمین و یک گروه کربوکسیل و یک زنجیرهٔ جانبی ساخته شده اند و با پیوندهای کوالانسی به هم متصلند. پیوند کوالانسی بین اسیدهای آمینه بسیار محکم است به طوری که امکان جابه جایی و چرخیدن به اتم های N - H و C=O را نمی دهد، اما سایر پیوندها دارای استحکام کمتری بوده و امکان چرخیدن برایشان وجود دارد. این ویژگی باعث می شود پروتئین ها خاصیت انعطاف پذیری پیدا کنند و بتوانند تا بخورند.
پروتیین ها در اثر تاخوردگی شکل فضایی ای را ایجاد می کنند که دارای کمترین انرژی است. وقتی پروتئین تا می خورد پیوندهای ضعیف غیر کوالانسی به تثبیت تا خوردگی کمک می کنند. این پیوندها عبارتند از: پیوند یونی، پیوند هیدروژنی، برهمکنش های واندروالس و نیروهای آب گریز.
همانطور که گفته شد زنجیره جانبی متصل به اسیدهای آمینه می توانند قطبی یا غیرقطبی باشند. وقتی پروتئین در آب سیتوزولی قرار می گیرد زنجیره های جانبی آب گریز تمایل دارند به صورت یک مجموعه در درون مولکول پروتئین قرار بگیرند تا حداقل تماس با مولکول های قطبی آب را داشته باشند و اثر تضعیف کنندۀ آن ها بر پیوندهای هیدروژنی آب حداقل باشد. از طرف دیگر زنجیره های جانبی ای که قطبی هستند تمایل دارند که در روی سطح مولکول پروتئین قرار بگیرند و با مولکول های آب یا سایر مولکول های قطبی پیوند هیدروژنی ایجاد کنند. بنابراین خاصیت آب گریزی زنجیره های جانبی در تعیین شکل پروتئین نقش اساسی دارد.

wiki: تاشدگی پروتئین
