امروزه فلز منیزیم و آلیاژهای آن به عنوان یک فلز زیست سازگار تخریب پذیر که خواص مکانیکی بسیار مشابه با خواص مکانیکی استخوان کنسلوس را نیز داراست، در حوزه پزشکی ( منیزیم آلیاژی در زیست پزشکی ) به خصوص داربست های استخوانی بسیار مورد توجه قرار گرفته اند. از طرفی علاوه بر اینکه تخریب پذیری منیزیم به عنوان یک ویژگی مثبت اطلاق می شود، نرخ خوردگی بالای آن نیز به همان اندازه می تواند یک نکته منفی و مخرب باشد؛ لذا در قسمت بعدی علاوه بر اشاره بر تاریخچه استفاده از منیزیم به مکانیزم خوردگی منیزیم در داخل بدن و همچنین روش های کنترل آن نیز مختصراً پرداخته شده است.
محدودیت بارز منیزیم نرخ خوردگی بالای آن است. دانشمندان تحقیق و پژوهش در زمینه کاربردهای منیزیم به عنوان یک ماده زیست سازگار تخریب پذیر در حوزه پزشکی را از قرن ۱۹ شروع کرده و با توجه به دلایل ذکر شده و پیشرفت های تکنولوژیکی در راستای کنترل نرخ خوردگی آن، تحقیق های صورت گرفته روی خواص و کابردهای آن در این حوزه روز به روز در حال توسعه می باشد. اولین بار فردی به نام ادوارد در اواخر قرن نوزدهم، برای بند آوردن خونریزی بیمار در طول عمل جراحی از یک سیم خاص منیزیمی استفاده کرد. در بازه زمانی پنجاه سال بعد نیز پزشکان در برخی از زمینه های عروقی، اورتوپدی و به طور کلی پزشکی از منیزیم استفاده کردند. اروین پایر از جمله پیشگامان یک سری از تحقیق های در راستای به کاربردن منیزیم در حوزه های پزشکی در حوالی قرن بیستم بود. وی حتی به موفقیت هایی نیز همچون استفاده از لوله منیزیمی در عمل جراحی آناستاموزی، صفحه های منیزیمی برای تعویض مفصل و سایر موارد رسید. پژوهش ها ها در این زمینه همچنان ادامه دارد و دانشمندان ایرانی نیز همانند خانم لوبت طیبی به بررسی و تحقیق روی داربست های متخلخل منیزیمی پرداخته و عملکرد خوردگی آنها را در محیط های آزمایشگاهی و در محیط های واقعی طی آزمایش های فراوان سنجیده اند. [ ۱]
نرخ خوردگی منیزم در محیط های آب نمکی بسیار زیاد است. خوردگی منیزیم در این محیط ها در دو مرحله و به شکل خوردگی الکتروشیمیایی رخ می دهد. به طور کلی هر واکنشی را که بتوان به دو واکنش جداگانه آندی و کاتدی تقسیم نمود، واکنش الکتروشیمیایی می نامند. در این خوردگی فلز تمایل دارد از یک سطح انرژی بالاتر به حالت پایدارتر برسد؛ لذا منیزیم تمایل دارد تحت واکنش آندی دو الکترون از دست داده و به یون منیزیم ( Mg2+ ) تبدیل شود. از طرفی همین دو الکترون موجب انجام واکنش کاتدی ۲ می شود. علاوه بر گاز هیدروژن، یون هیدروکسید نیز تولید خواهد شد. یون هیدروکسید شدیداً موجب بازی شدن محیط و نهایتاً تأثیر منفی بر روی عملکرد سلول های بافت های محلی می شود. رشد گاز هیدروژن ایجاد شده موجب ایجاد حفره هایی در بافت های مجاور می شود؛ بنابراین نرخ تخریب منیزیم در محیط سیال بدن باید کنترل شده باشد تا هیچ گونه اثر سوئی در بافت های مجاور ایجاد نکند. علاوه بر موارد بالا طی واکنش نهایی ۳ که حاصل دو واکنش اول می باشد، یک لایه منیزیم هیدروکسید بر روی ایمپلنت های منیزیمی ایجاد می شود که لایه محافظ بسیار نازکی در مقابل خوردگی می باشد. وجود یون های کلریدی در محلول نمکی باعث تخریب این لایه هیدروکسیدی می شود. در محیط هایی با غلظت کلرید بالا، عموماً کلرید توسط سطح ایمپلنت جذب و طی واکنشی های ۴ و ۵ خود منیزیم و منیزیم هیدروکسید به MgCl2 تبدیل می شود. این ترکیب بسیار حل پذیر است؛ بنابراین باعث حل سریع لایه منیزیمی و مجدداً ایجاد لایه هیدروکسیدی و گاز هیدروژن خواهد شد که خود عامل تسریع خوردگی منیزیم می باشند. خوردگی در ایمپلنت های منیزیمی نیز عموماً بر اساس فازهای تشکیل دهنده به دو نوع محلی و خوردگی گالوانیک تقسیم می شود. اگر ایمپلنت ساخته شده فقط از یک فاز باشد، خوردگی محلی حفره ای رخ می دهد. حضور فاز دوم مانند فازهای آلیاژی موجب ایجاد خوردگی میکروگالوانیک نیز خواهد شد. چرا که فاز ثانویه به عنوان کاتد محلی عمل می کند. پس بنابراین با وجود اینکه خوردگی منیزیم می تواند به عنوان ویژگی مثبت در بسیاری از ایمپلنت ها به شمار بیاید اما از طرفی نرخ خوردگی بالای آن باید تحت کنترل درآمده و متناسب با کاربرد آن به مقادیر مناسب دلخواه نزدیک شود. کنترل نرخ خوردگی منیزیم با کنترل عوامل تأثیرگذار بر آن امکان پذیر است. خوردگی منیزیم تحت تأثیر عوامل مختلفی است که در شکل نشان داده شده اند. [ ۲]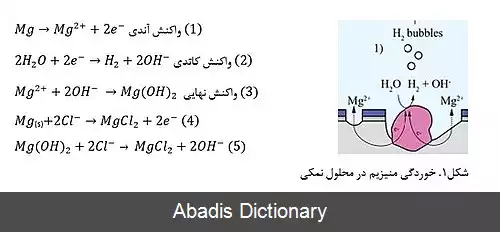

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفمحدودیت بارز منیزیم نرخ خوردگی بالای آن است. دانشمندان تحقیق و پژوهش در زمینه کاربردهای منیزیم به عنوان یک ماده زیست سازگار تخریب پذیر در حوزه پزشکی را از قرن ۱۹ شروع کرده و با توجه به دلایل ذکر شده و پیشرفت های تکنولوژیکی در راستای کنترل نرخ خوردگی آن، تحقیق های صورت گرفته روی خواص و کابردهای آن در این حوزه روز به روز در حال توسعه می باشد. اولین بار فردی به نام ادوارد در اواخر قرن نوزدهم، برای بند آوردن خونریزی بیمار در طول عمل جراحی از یک سیم خاص منیزیمی استفاده کرد. در بازه زمانی پنجاه سال بعد نیز پزشکان در برخی از زمینه های عروقی، اورتوپدی و به طور کلی پزشکی از منیزیم استفاده کردند. اروین پایر از جمله پیشگامان یک سری از تحقیق های در راستای به کاربردن منیزیم در حوزه های پزشکی در حوالی قرن بیستم بود. وی حتی به موفقیت هایی نیز همچون استفاده از لوله منیزیمی در عمل جراحی آناستاموزی، صفحه های منیزیمی برای تعویض مفصل و سایر موارد رسید. پژوهش ها ها در این زمینه همچنان ادامه دارد و دانشمندان ایرانی نیز همانند خانم لوبت طیبی به بررسی و تحقیق روی داربست های متخلخل منیزیمی پرداخته و عملکرد خوردگی آنها را در محیط های آزمایشگاهی و در محیط های واقعی طی آزمایش های فراوان سنجیده اند. [ ۱]
نرخ خوردگی منیزم در محیط های آب نمکی بسیار زیاد است. خوردگی منیزیم در این محیط ها در دو مرحله و به شکل خوردگی الکتروشیمیایی رخ می دهد. به طور کلی هر واکنشی را که بتوان به دو واکنش جداگانه آندی و کاتدی تقسیم نمود، واکنش الکتروشیمیایی می نامند. در این خوردگی فلز تمایل دارد از یک سطح انرژی بالاتر به حالت پایدارتر برسد؛ لذا منیزیم تمایل دارد تحت واکنش آندی دو الکترون از دست داده و به یون منیزیم ( Mg2+ ) تبدیل شود. از طرفی همین دو الکترون موجب انجام واکنش کاتدی ۲ می شود. علاوه بر گاز هیدروژن، یون هیدروکسید نیز تولید خواهد شد. یون هیدروکسید شدیداً موجب بازی شدن محیط و نهایتاً تأثیر منفی بر روی عملکرد سلول های بافت های محلی می شود. رشد گاز هیدروژن ایجاد شده موجب ایجاد حفره هایی در بافت های مجاور می شود؛ بنابراین نرخ تخریب منیزیم در محیط سیال بدن باید کنترل شده باشد تا هیچ گونه اثر سوئی در بافت های مجاور ایجاد نکند. علاوه بر موارد بالا طی واکنش نهایی ۳ که حاصل دو واکنش اول می باشد، یک لایه منیزیم هیدروکسید بر روی ایمپلنت های منیزیمی ایجاد می شود که لایه محافظ بسیار نازکی در مقابل خوردگی می باشد. وجود یون های کلریدی در محلول نمکی باعث تخریب این لایه هیدروکسیدی می شود. در محیط هایی با غلظت کلرید بالا، عموماً کلرید توسط سطح ایمپلنت جذب و طی واکنشی های ۴ و ۵ خود منیزیم و منیزیم هیدروکسید به MgCl2 تبدیل می شود. این ترکیب بسیار حل پذیر است؛ بنابراین باعث حل سریع لایه منیزیمی و مجدداً ایجاد لایه هیدروکسیدی و گاز هیدروژن خواهد شد که خود عامل تسریع خوردگی منیزیم می باشند. خوردگی در ایمپلنت های منیزیمی نیز عموماً بر اساس فازهای تشکیل دهنده به دو نوع محلی و خوردگی گالوانیک تقسیم می شود. اگر ایمپلنت ساخته شده فقط از یک فاز باشد، خوردگی محلی حفره ای رخ می دهد. حضور فاز دوم مانند فازهای آلیاژی موجب ایجاد خوردگی میکروگالوانیک نیز خواهد شد. چرا که فاز ثانویه به عنوان کاتد محلی عمل می کند. پس بنابراین با وجود اینکه خوردگی منیزیم می تواند به عنوان ویژگی مثبت در بسیاری از ایمپلنت ها به شمار بیاید اما از طرفی نرخ خوردگی بالای آن باید تحت کنترل درآمده و متناسب با کاربرد آن به مقادیر مناسب دلخواه نزدیک شود. کنترل نرخ خوردگی منیزیم با کنترل عوامل تأثیرگذار بر آن امکان پذیر است. خوردگی منیزیم تحت تأثیر عوامل مختلفی است که در شکل نشان داده شده اند. [ ۲]


