محلول بافر ( به انگلیسی: Buffer solution ) یا محلول تامپون، یک محلول شیمیایی است که از یک اسید ضعیف و نمک آن یا یک باز ضعیف و نمک آن ساخته می شود. محلول های بافر توانایی حفظ پی اچ محلول را حتی در صورت افزودن اندکی باز یا اسید دارند. خون یک نمونهٔ مهم از این نوع محلول ها است. در طبیعت، سیستم های زنده زیادی وجود دارد که از بافر برای تنظیم pH استفاده می کنند. به عنوان مثال، سیستم بافر بی کربنات برای تنظیم pHخون استفاده می شود. بافرها موادی هستند که از تغییرات زیاد پی اچ جلوگیری می کنند و از جمله آن ها می توان به پروتئین ها در بدن اشاره کرد. [ ۱]
جدول زیر نام و مشخصات برخی بافرهای مشهور را بیان کرده است:[ ۲]
محلول های بافر برای حفظ پی اچ صحیح برای عملکرد آنزیم ها در بسیاری از جانداران ضروری هستند.
بسیاری از آنزیم ها تنها در شرایط دقیقی کار می کنند؛ اگر پی اچ در محدودهٔ بسیار کمی تغییر کند عملکرد آنزیم ها کند یا متوقف می شود و دچار تغییر ماهیت می شوند. در بسیاری از موارد، تغییر ماهیت می تواند به طور ثابت فعالیت کاتالیزوری را از کار بیاندازد.
بافر کربنیک اسید ( H2CO3 ) و بی کربنات ( - HCO3 ) در پلاسمای خون موجود است که برای حفظ پی اچ بین ۷٫۳۵ تا ۷٫۴۵ به کار می رود. [ ۴]
از لحاظ کاری و صنعتی محلول های بافر در فرایند تخمیر و در تعیین شرایط مناسب برای رنگ های موجود در رنگ آمیزی پارچه به کار می روند.
بافرها همچنین در تجزیه و تحلیل های شیمیایی و کالیبراسیون پی اچ سنج ها به کار می روند.
از بزرگ ترین نمونه های زیستی ( بیولوژیکی ) استفاده از آن ها می توان به تحقیق هایی اشاره کرد که در آن مواد در بافر ساخته می شوند؛ به ویژه بافر فسفات نمکی ( PBS ) که در پی اچ = ۷٫۴ مورد استفاده قرار می گیرد.
علت اصلی استفاده از بافرها این است که سلول ها، آنزیم ها و باکتری ها برای کارکرد درست، نیاز است که در پی اچ مشخصی فعالیت کنند. به همین دلیل نیز از بافرها در بسیاری از کاربردهای زیستی استفاده می شود.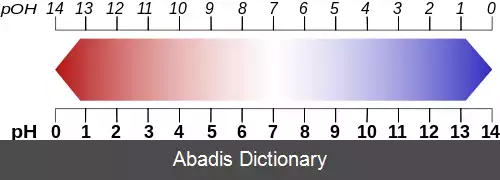
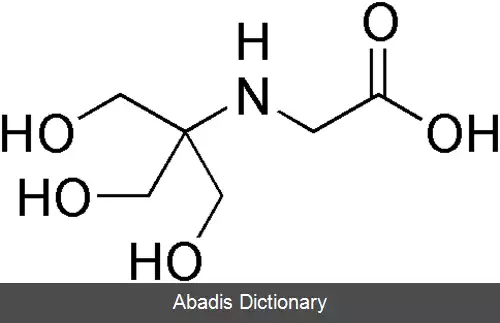
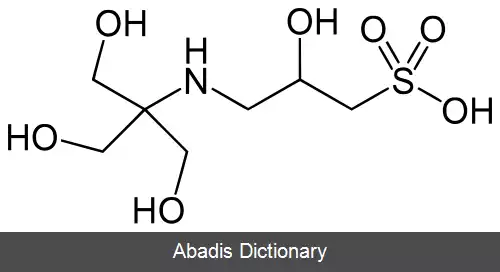
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفجدول زیر نام و مشخصات برخی بافرهای مشهور را بیان کرده است:[ ۲]
محلول های بافر برای حفظ پی اچ صحیح برای عملکرد آنزیم ها در بسیاری از جانداران ضروری هستند.
بسیاری از آنزیم ها تنها در شرایط دقیقی کار می کنند؛ اگر پی اچ در محدودهٔ بسیار کمی تغییر کند عملکرد آنزیم ها کند یا متوقف می شود و دچار تغییر ماهیت می شوند. در بسیاری از موارد، تغییر ماهیت می تواند به طور ثابت فعالیت کاتالیزوری را از کار بیاندازد.
بافر کربنیک اسید ( H2CO3 ) و بی کربنات ( - HCO3 ) در پلاسمای خون موجود است که برای حفظ پی اچ بین ۷٫۳۵ تا ۷٫۴۵ به کار می رود. [ ۴]
از لحاظ کاری و صنعتی محلول های بافر در فرایند تخمیر و در تعیین شرایط مناسب برای رنگ های موجود در رنگ آمیزی پارچه به کار می روند.
بافرها همچنین در تجزیه و تحلیل های شیمیایی و کالیبراسیون پی اچ سنج ها به کار می روند.
از بزرگ ترین نمونه های زیستی ( بیولوژیکی ) استفاده از آن ها می توان به تحقیق هایی اشاره کرد که در آن مواد در بافر ساخته می شوند؛ به ویژه بافر فسفات نمکی ( PBS ) که در پی اچ = ۷٫۴ مورد استفاده قرار می گیرد.
علت اصلی استفاده از بافرها این است که سلول ها، آنزیم ها و باکتری ها برای کارکرد درست، نیاز است که در پی اچ مشخصی فعالیت کنند. به همین دلیل نیز از بافرها در بسیاری از کاربردهای زیستی استفاده می شود.






wiki: محلول بافر
