در یک اتم تنها، الکترون ها در سطوح انرژی مجزا و کوانتیده قرار دارند. این سطوح انرژی یا اوربیتال ها از انرژی پایین تر شروع به پر شدن می کنند. وقتی اتم ها در کنار یکدیگر قرار می گیرند، حالت های مجاز انرژی به حالت های نزدیک به هم تقسیم می شوند و شکل اربیتال ها تغییر می کند. اربیتال های یک مولکول با اربیتال های اتم های تشکیل دهنده اش متفاوت است. در جامدات ( که اکثراً به شکل کریستال هستند ) این حالت های تقسیم شده به صورت پیوسته درمی آیند و نوارهای پهنی از انرژی تشکیل می دهند.
وقتی اتم ها یک مولکول تشکیل می دهند، اربیتال های جدید پیوندی و ضد پیوندی شکل می گیرند که سطح انرژی آن ها با اربیتال های اتمی متفاوت است. تشکیل اربیتال های جدید باعت به وجود آمدن چندگانگی در سطوح انرژی می شود. با شکل گیری جامد و نزدیکی زیاده از حد اربیتال ها، اربیتال های پیوندی نوار ظرفیت را، و اربیتال های ضد پیوندی نوار رسانش را به وجود می آورند.
این اربیتال ها یا سطوح انرژی مجزا، در جامد تبدیل به یک نوار پیوسته می شوند که شامل N سطح انرژی است. N از مرتبه ۱۰۲۳ است. در کریستال یا جامدات حالت های الکترونیکی مکان خاصی ندارند و به علت تقارن کریستال نسبت به حرکت انتقالی ناوردا هستند. [ ۱]
ویژگی های اپتیکی مواد به چگونگی پر شدن این نوارها توسط الکترون ها بستگی دارد. از نظر هدایت الکتریکی، بر حسب پر شدن این باندها سه گروه اصلی داریم: فلزات، نارساناها و نیمه رساناها. در فلزات نوار ظرفیت تکمیل است و قمستی از نوار رسانش نیز توسط الکترون ها پر شده است. اما قسمت خالی نوار رسانش این اجازه را به الکترون ها می دهد که با به دست آوردن کمی انرژی بتوانند آزادانه حرکت کنند. در نارساناها باند ظرفیت تکمیل است و هیچ الکترونی در باند رسانش وجود ندارد. چون اختلاف انرژی بین بالاترین حد نوار ظرفیت و پایین تر حد نوار رسانش زیاد است؛ که نوار ممنوعه خوانده شده، و الکترون ها نمی توانند به باند رسانش بروند و آزادانه حرکت کنند. در نیمه رساناها باند ظرفیت ( در دمای صفر کلوین ) پر است، اما به علت کم بودن پهنای نوار ممنوعه، الکترون ها با به دست آوردن کمی انرژی؛ ( مثلاً از طریق حرارت ) ، می توانند به باند رسانش بروند و آزادنه حرکت کنند. نیمه رساناها با بالا رفتن دما به رسانا تبدیل می شوند.
یک تک الکترونِ منزوی، اوربیتال های اتمی را اشغال می کند. هر اوربیتال هم در سطح انرژی گسسته ای است. هنگامی که اتم های متعددی با به هم پیوستن به شکل یک مولکول درآیند، اوربیتالِ اتمیِ آن ها به هم می پیوندد تا اوربیتال مولکولی تشکیل شود، که هر کدام در سطح انرژی گسسته ای هستند. هرچه اتم های بیشتری گِرد هم آیند، اوربیتال مولکولی بزرگتر و گسترده تر می گردد، و سطوح انرژی مولکولی به طور فزاینده متراکم تر خواهد شد. در نهایت، مجموعهٔ اتم ها به تشکیل یک مولکول غول پیکر؛ یا به عبارتی دیگر، یک جامد خواهد انجامید. برای این مولکول غول پیکر، سطوح انرژی آنقدر به هم نزدیک اند که می توان آن ها را به شکل یک زنجیره در نظر گرفت.
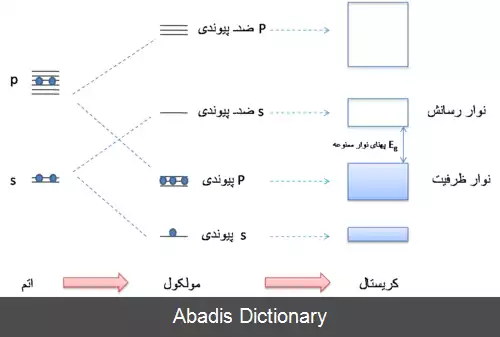
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفوقتی اتم ها یک مولکول تشکیل می دهند، اربیتال های جدید پیوندی و ضد پیوندی شکل می گیرند که سطح انرژی آن ها با اربیتال های اتمی متفاوت است. تشکیل اربیتال های جدید باعت به وجود آمدن چندگانگی در سطوح انرژی می شود. با شکل گیری جامد و نزدیکی زیاده از حد اربیتال ها، اربیتال های پیوندی نوار ظرفیت را، و اربیتال های ضد پیوندی نوار رسانش را به وجود می آورند.
این اربیتال ها یا سطوح انرژی مجزا، در جامد تبدیل به یک نوار پیوسته می شوند که شامل N سطح انرژی است. N از مرتبه ۱۰۲۳ است. در کریستال یا جامدات حالت های الکترونیکی مکان خاصی ندارند و به علت تقارن کریستال نسبت به حرکت انتقالی ناوردا هستند. [ ۱]
ویژگی های اپتیکی مواد به چگونگی پر شدن این نوارها توسط الکترون ها بستگی دارد. از نظر هدایت الکتریکی، بر حسب پر شدن این باندها سه گروه اصلی داریم: فلزات، نارساناها و نیمه رساناها. در فلزات نوار ظرفیت تکمیل است و قمستی از نوار رسانش نیز توسط الکترون ها پر شده است. اما قسمت خالی نوار رسانش این اجازه را به الکترون ها می دهد که با به دست آوردن کمی انرژی بتوانند آزادانه حرکت کنند. در نارساناها باند ظرفیت تکمیل است و هیچ الکترونی در باند رسانش وجود ندارد. چون اختلاف انرژی بین بالاترین حد نوار ظرفیت و پایین تر حد نوار رسانش زیاد است؛ که نوار ممنوعه خوانده شده، و الکترون ها نمی توانند به باند رسانش بروند و آزادانه حرکت کنند. در نیمه رساناها باند ظرفیت ( در دمای صفر کلوین ) پر است، اما به علت کم بودن پهنای نوار ممنوعه، الکترون ها با به دست آوردن کمی انرژی؛ ( مثلاً از طریق حرارت ) ، می توانند به باند رسانش بروند و آزادنه حرکت کنند. نیمه رساناها با بالا رفتن دما به رسانا تبدیل می شوند.
یک تک الکترونِ منزوی، اوربیتال های اتمی را اشغال می کند. هر اوربیتال هم در سطح انرژی گسسته ای است. هنگامی که اتم های متعددی با به هم پیوستن به شکل یک مولکول درآیند، اوربیتالِ اتمیِ آن ها به هم می پیوندد تا اوربیتال مولکولی تشکیل شود، که هر کدام در سطح انرژی گسسته ای هستند. هرچه اتم های بیشتری گِرد هم آیند، اوربیتال مولکولی بزرگتر و گسترده تر می گردد، و سطوح انرژی مولکولی به طور فزاینده متراکم تر خواهد شد. در نهایت، مجموعهٔ اتم ها به تشکیل یک مولکول غول پیکر؛ یا به عبارتی دیگر، یک جامد خواهد انجامید. برای این مولکول غول پیکر، سطوح انرژی آنقدر به هم نزدیک اند که می توان آن ها را به شکل یک زنجیره در نظر گرفت.



wiki: نظریه نوارها
