همه اتم ها در مولکول ها توسط پیوندهای کووالانسی کنار هم نگه داشته شده اند. اما پرسش این است که مولکول ها در حال مایع و جامد توسط چه نیروهایی به سوی یکدیگر جذب می شوند، نیروهایی که مولکول های یک ماده را در حالت مایع یا جامد به همدیگر ارتباط می دهند به نیروهای بین مولکولی معروف هستند.
نیروهای بین مولکولی بین مولکول های قطبی با نیروهای بین مولکولی بین مولکول های غیرقطبی باهم تفاوت دارند. معمولاً نیروهای بین مولکولی به نام نیروهای واندِروالسی معروفند. [ ۱] وجود این نیروها در بین مولکول ها باعث می شود که یک ترکیب جامد مولکولی شکل معینی داشته باشد و با غلبه بر این نیروها بتوان آن را به حالت مایع درآورد.
اولین بار یوهان واندروالس در سال ۱۸۷۳ میلادی وجود نیروهای کشش بین مولکولی در میان مولکولهای گاز را مطرح کرد، به نظر واندروالس مجموع این نیروها هستند که مقدار انحراف یک گاز حقیقی از گاز ایده آل را معین می کنند توضیح خاستگاه این نیروهای بین مولکولی توسط فریتز لاندن در ۱۹۳۰ پیشنهاد شد.
امروزه نیروهای بین مولکولی را به صورت عام نیروهای واندروالس و نیروهای پراکندگی بین مولکولهای غیرقطبی را نیروهای لاندن می نامند. [ ۲]
نیروهای دوقطبی - دوقطبی این نیروها بین مولکولهای قطبی دیده می شوند. این مولکولها دارای دوقطبی های دائمی هستند و تمایل به قرار گرفتن در راستای میدان الکتریکی دارند. پایدارترین حالت زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکولهای مجاور یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی به وجود می آید.
با توجه به مقادیر الکترونگاتیوی اتم ها در یک مولکول دو اتمی می توان میزان قطبیت مولکول و جهت گیری قطبهای مثبت و منفی را پیش بینی کرد اما پیش بینی قطبیت مولکول های چند اتمی باید مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترون های غیرمشترک باشد.
پیوند هیدروژنی نوعی نیروی بین مولکولی است که در آن بین اتم هیدروژن ( H ) از یک مولکول با اتم های الکترونگاتیو، فلوئور ( F ) و اکسیژن ( O ) و نیتروژن ( N ) از مولکول های دیگر جاذبه ای بوجود می آید که به پیوند هیدروژنی معروف است. پیوند هیدروژنی بین ترکیبات اتم های F, O، و N با هیدروژن وجود دارد، یعنی در این ترکیبات به خاطر اختلاف الکترونگاتیوی و توزیع نامساوی الکترون بر روی اتم ها هیدروژن دارای کمی بار مثبت و اتم الکترونگاتیوتر دارای کمی بار منفی می شود و هیدروژن به عنوان پلی بین دو اتم الکترونگاتیو عمل می کند. این پیوندها می توانند بین ملکول های مختلف یا بین اتم های مختلف یک مولکول رخ دهند. [ ۳] انرژی لازم برای شکستن یک مول پیوند هیدروژنی از حدود ۱ تا ۱۰ کیلوکالری متغیر است.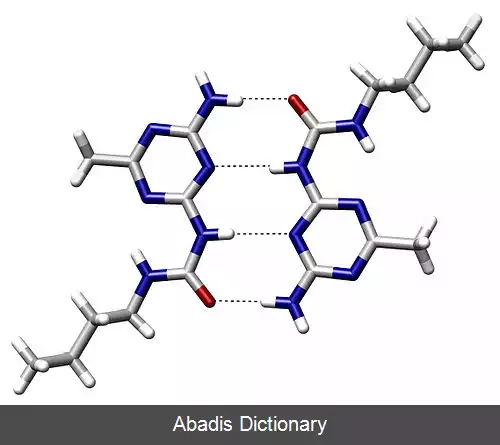
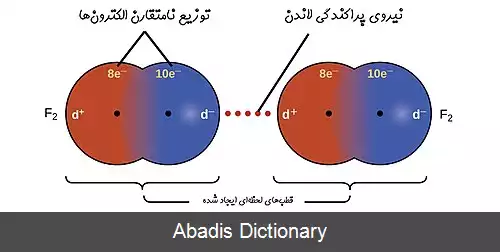
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفنیروهای بین مولکولی بین مولکول های قطبی با نیروهای بین مولکولی بین مولکول های غیرقطبی باهم تفاوت دارند. معمولاً نیروهای بین مولکولی به نام نیروهای واندِروالسی معروفند. [ ۱] وجود این نیروها در بین مولکول ها باعث می شود که یک ترکیب جامد مولکولی شکل معینی داشته باشد و با غلبه بر این نیروها بتوان آن را به حالت مایع درآورد.
اولین بار یوهان واندروالس در سال ۱۸۷۳ میلادی وجود نیروهای کشش بین مولکولی در میان مولکولهای گاز را مطرح کرد، به نظر واندروالس مجموع این نیروها هستند که مقدار انحراف یک گاز حقیقی از گاز ایده آل را معین می کنند توضیح خاستگاه این نیروهای بین مولکولی توسط فریتز لاندن در ۱۹۳۰ پیشنهاد شد.
امروزه نیروهای بین مولکولی را به صورت عام نیروهای واندروالس و نیروهای پراکندگی بین مولکولهای غیرقطبی را نیروهای لاندن می نامند. [ ۲]
نیروهای دوقطبی - دوقطبی این نیروها بین مولکولهای قطبی دیده می شوند. این مولکولها دارای دوقطبی های دائمی هستند و تمایل به قرار گرفتن در راستای میدان الکتریکی دارند. پایدارترین حالت زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکولهای مجاور یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی به وجود می آید.
با توجه به مقادیر الکترونگاتیوی اتم ها در یک مولکول دو اتمی می توان میزان قطبیت مولکول و جهت گیری قطبهای مثبت و منفی را پیش بینی کرد اما پیش بینی قطبیت مولکول های چند اتمی باید مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترون های غیرمشترک باشد.
پیوند هیدروژنی نوعی نیروی بین مولکولی است که در آن بین اتم هیدروژن ( H ) از یک مولکول با اتم های الکترونگاتیو، فلوئور ( F ) و اکسیژن ( O ) و نیتروژن ( N ) از مولکول های دیگر جاذبه ای بوجود می آید که به پیوند هیدروژنی معروف است. پیوند هیدروژنی بین ترکیبات اتم های F, O، و N با هیدروژن وجود دارد، یعنی در این ترکیبات به خاطر اختلاف الکترونگاتیوی و توزیع نامساوی الکترون بر روی اتم ها هیدروژن دارای کمی بار مثبت و اتم الکترونگاتیوتر دارای کمی بار منفی می شود و هیدروژن به عنوان پلی بین دو اتم الکترونگاتیو عمل می کند. این پیوندها می توانند بین ملکول های مختلف یا بین اتم های مختلف یک مولکول رخ دهند. [ ۳] انرژی لازم برای شکستن یک مول پیوند هیدروژنی از حدود ۱ تا ۱۰ کیلوکالری متغیر است.


wiki: نیروی واندروالسی
