پیوند کووالانسی ( به انگلیسی: Covalent bond ) یا رابطه اشتراکی[ ۱] یا بند هم ارزا یک نوع رابطه شیمیایی در شیمی است. در ترکیب یونی، اتم ها با از دست دادن یا گرفتن الکترون، مدار بیرونی خود را پر می کنند. اما در رابطه اشتراکی ( کووالانسی ) اتم ها می توانند با اشتراک الکترون ها مدار خودشان را پر کنند و به آرایش هشت تایی پایدار گاز نجیب بعد از خودشان برسند. پیوند کووالانسی بین نافلزات مشابه یا غیرمشابه با اشتراک الکترون های مدار آخر انجام می شود؛ ( البته دارای استثنا است پیوند بین آمونیوم نافلزی با نافلزات از نوع پیوند یونی میباشند ) . پیوند کووالانسی را با خط راست نشان می دهند و در هر پیوند ( ۲ ) الکترون شرکت دارند. پیوند کووالانسی می تواند《یک گانه، دوگانه یا سه گانه》باشد. موادی که پیوند کووالانسی دارند در هیچ شرایطی برق را عبور نمی دهند؛ البته گرافیت از این قضیه مستثنی است. موادی که پیوند کووالانسی دارند نقطه جوش و ذوب پایین تری نسبت به موادی با پیوند یونی دارند و بین آن ها هر کدام که جرم مولکولی بیشتری دارد دارای نقطه جوش و ذوب بالاتری است. به جز هیدروژن در بقیه اتم ها مجموع الکترون های پیوند و غیر پیوندی در لایه ظرفیت باید هشتایی باشد. تمام گازها، قندها، الکل ها، پلیمرها، سوخت ها و آب پیوند کووالانسی دارند. پیوند کووالانسی نیروی جاذبه بسیار قوی دارد که اتم ها را به شدت کنار هم نگه می دارد، به همین خاطر به ترکیب مولکولی معروفند. البته شایان ذکر است که آب فراوان ترین ترکیب مولکولی است که به سه حالت جامد مایع وگاز یافت می شود. نام دیگر این پیوند اشتراکی نیز است.
پیوند کووالانسی در اثر نیروی جاذبهٔ الکتریکی به وجود می آید؛ به طور مثال هنگامی که دو اتم هیدروژن به هم نزدیک می شوند، جاذبهٔ الکتریکی بین آن ها ایجاد می شود و دو اتم با هم رسانی یک جفت الکترون کنار هم می مانند. پیوند کووالانسی اغلب بین دو اتم نافلز است؛ مثلاً یک اتم کربن با چهار اتم هیدروژن چهار پیوند کووالانسی در یک مولکول به وجود می آورند که به متان معروف است.
بر اساس نظریه لوویس، پیوند کووالانسی نتیجه اشتراک یک جفت الکترون ( =دو الکترون ) بین دو اتم است. بر این اساس، الکترون های مشترک توسط هسته هر دو اتم جذب می شوند و مانند چسب، منجر می شوند که دو هسته نزدیک به هم بمانند و اتم ها به هم پیوند ( اتصال ) یابند. طبق نظریه لوویس، اتم هر عنصر تا جایی پیوند برقرار می کند که جمع الکترون های پیوندی ( =الکترون های مشترک ) و الکترون های نا پیوندی آخرین لایه الکترونی اش برابر با ۸ شود ( مشابه گازهای نجیب؛ به جز هیدروژن که همانند هلیم، و فقط دارای ۲ الکترون می شود ) . این قاعده به قاعده هشت تایی ( هشتایی ) یا همان اوکتت ( Octet ) معروف است. [ ۲]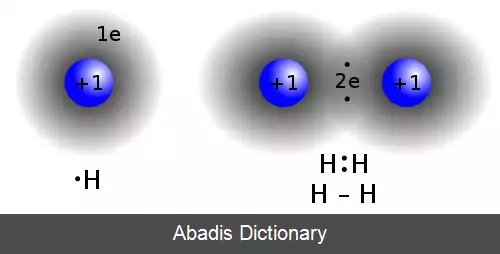
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفپیوند کووالانسی در اثر نیروی جاذبهٔ الکتریکی به وجود می آید؛ به طور مثال هنگامی که دو اتم هیدروژن به هم نزدیک می شوند، جاذبهٔ الکتریکی بین آن ها ایجاد می شود و دو اتم با هم رسانی یک جفت الکترون کنار هم می مانند. پیوند کووالانسی اغلب بین دو اتم نافلز است؛ مثلاً یک اتم کربن با چهار اتم هیدروژن چهار پیوند کووالانسی در یک مولکول به وجود می آورند که به متان معروف است.
بر اساس نظریه لوویس، پیوند کووالانسی نتیجه اشتراک یک جفت الکترون ( =دو الکترون ) بین دو اتم است. بر این اساس، الکترون های مشترک توسط هسته هر دو اتم جذب می شوند و مانند چسب، منجر می شوند که دو هسته نزدیک به هم بمانند و اتم ها به هم پیوند ( اتصال ) یابند. طبق نظریه لوویس، اتم هر عنصر تا جایی پیوند برقرار می کند که جمع الکترون های پیوندی ( =الکترون های مشترک ) و الکترون های نا پیوندی آخرین لایه الکترونی اش برابر با ۸ شود ( مشابه گازهای نجیب؛ به جز هیدروژن که همانند هلیم، و فقط دارای ۲ الکترون می شود ) . این قاعده به قاعده هشت تایی ( هشتایی ) یا همان اوکتت ( Octet ) معروف است. [ ۲]

wiki: پیوند کووالانسی
