خواص کولیگاتیو ( به انگلیسی: Colligative properties ) خواصی از یک محلول می باشد که به غلظت ذرات حل شده در آن بستگی داشته باشد نه به نوع و ماهیت این ذرات. این خواص عبارت اند از:فشار بخار، دمای انجماد، دمای جوش و ]. [ ۱]
چون خواص کولیگاتیو وابسته به غلظت هستند متأثر از آن نیز هستند.
تبخیر سطحی به معنی جدا شدن مولکول های مایع از سطح آن است که می تواند بر اثر آن به دیواره های ظرف، مولکول های هوا و… فشار وارد شود، فشار ناشی از حضور مولکول های بخار مایع در بالای سطح آن را فشار بخار می گویند، این فشار در دمای معین ثابت است
در اثر افزایش غلظت به جای تعدادی از مولکول های حلال مولکول های حل شونده قرار می گیرند اگر حل شونده غیر فرار باشد آن گاه به خاطر کاهش تعداد مولکول های تبخیر شده فشار بخار مایع کاهش میابد[ ۲] [ ۳]
تبخیر زمانی رخ می دهد که فشار بخار مایع با فشار هوای محیط برابر شود، چون افزایش غلظت فشار بخار محلول را کاهش می دهد در نتیجه انرژی بیشتری نیاز است تا مولکول های عمقی تر محلول بر اثر جنب و جوش خود به سطح آمده تبخیر شده و باعث افزایش فشار بخار شوند در نتیجه افزایش غلظت باعث افزایش نقطهٔ جوش ( میعان ) هستند[ ۲] [ ۳]
به طور کلی از فرمول زیر محاسبه می شود:
Tb = Kb X m∆ در این معادله Tb∆ صعود نقطه جوش بر حسب درجه سیلسیوس، m مولاریته و Kb ثابت مربوط به حلال مورد نظر است[ ۴] ( در بخش پیوست برخی Kb هایی را برای نمونه ذکر کرده ایم ) .
از آن جا که Kb برای آب ۰٫۵۲ درجه می باشد[ ۳] [ ۴] از فرمول زیر محاسبه می گردد
میزان افزایش دمای نقطهٔ جوش=۰/۶۲*تعداد مول حاصل از انحلال یک مول حل شونده*غلظت مولال. [ ۳]
• برای خود به خودی بودن واکنش نیاز است عوامل آنتالپی و آنتروپی بررسی شوند
• زمانی عامل آنتروپی مساعد است که تغییرات آنتروپی مثبت باشد
• زمانی عامل آنتالپی مساعد است که تغییرات آن منفی باشد
• آنتروپی یخ از آب کمتر است
• آنتروپی محلول هاز از مایع خالص بیشتر است
• به طور کلی امکان خود به خودی بودن یا نبودن واکنش از طریق فرمول انرژی آزاد گیبس بررسی می شود پس واکنش هایی که عامل آنتروپی نا مساعد دارند برای انجام نیاز به عامل آنتاپی مساعد دارند.
چون حالت جامد آنتروپی کمتری نسبت به مایع دارد فرایند انجماد باید با کاهش آنتالپی همراه باشد، چون آنتروپی محلول بیشتر از مایع خالص است پس تغیرات آنتروپی آن برای انجماد شدید تر است ( یشتر کاهش میاد ) پس برای اینکه از نظر ترمودینامیکی وقوع آن ممکن شود لازم است تغییرات آنتالپی آن نیز شدید تر باشد ( بیشتر کاهش یابد ) پس افزایش غلظت موجب کاهش یافتن دمای انجماد ( ذوب ) می شود. [ ۲] [ ۳]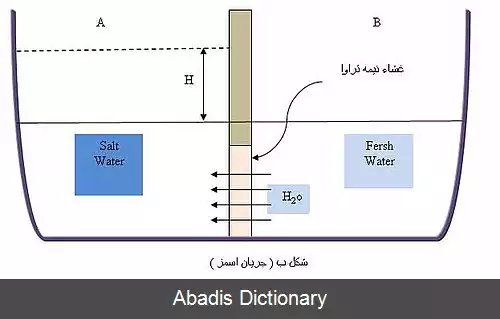
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفچون خواص کولیگاتیو وابسته به غلظت هستند متأثر از آن نیز هستند.
تبخیر سطحی به معنی جدا شدن مولکول های مایع از سطح آن است که می تواند بر اثر آن به دیواره های ظرف، مولکول های هوا و… فشار وارد شود، فشار ناشی از حضور مولکول های بخار مایع در بالای سطح آن را فشار بخار می گویند، این فشار در دمای معین ثابت است
در اثر افزایش غلظت به جای تعدادی از مولکول های حلال مولکول های حل شونده قرار می گیرند اگر حل شونده غیر فرار باشد آن گاه به خاطر کاهش تعداد مولکول های تبخیر شده فشار بخار مایع کاهش میابد[ ۲] [ ۳]
تبخیر زمانی رخ می دهد که فشار بخار مایع با فشار هوای محیط برابر شود، چون افزایش غلظت فشار بخار محلول را کاهش می دهد در نتیجه انرژی بیشتری نیاز است تا مولکول های عمقی تر محلول بر اثر جنب و جوش خود به سطح آمده تبخیر شده و باعث افزایش فشار بخار شوند در نتیجه افزایش غلظت باعث افزایش نقطهٔ جوش ( میعان ) هستند[ ۲] [ ۳]
به طور کلی از فرمول زیر محاسبه می شود:
Tb = Kb X m∆ در این معادله Tb∆ صعود نقطه جوش بر حسب درجه سیلسیوس، m مولاریته و Kb ثابت مربوط به حلال مورد نظر است[ ۴] ( در بخش پیوست برخی Kb هایی را برای نمونه ذکر کرده ایم ) .
از آن جا که Kb برای آب ۰٫۵۲ درجه می باشد[ ۳] [ ۴] از فرمول زیر محاسبه می گردد
میزان افزایش دمای نقطهٔ جوش=۰/۶۲*تعداد مول حاصل از انحلال یک مول حل شونده*غلظت مولال. [ ۳]
• برای خود به خودی بودن واکنش نیاز است عوامل آنتالپی و آنتروپی بررسی شوند
• زمانی عامل آنتروپی مساعد است که تغییرات آنتروپی مثبت باشد
• زمانی عامل آنتالپی مساعد است که تغییرات آن منفی باشد
• آنتروپی یخ از آب کمتر است
• آنتروپی محلول هاز از مایع خالص بیشتر است
• به طور کلی امکان خود به خودی بودن یا نبودن واکنش از طریق فرمول انرژی آزاد گیبس بررسی می شود پس واکنش هایی که عامل آنتروپی نا مساعد دارند برای انجام نیاز به عامل آنتاپی مساعد دارند.
چون حالت جامد آنتروپی کمتری نسبت به مایع دارد فرایند انجماد باید با کاهش آنتالپی همراه باشد، چون آنتروپی محلول بیشتر از مایع خالص است پس تغیرات آنتروپی آن برای انجماد شدید تر است ( یشتر کاهش میاد ) پس برای اینکه از نظر ترمودینامیکی وقوع آن ممکن شود لازم است تغییرات آنتالپی آن نیز شدید تر باشد ( بیشتر کاهش یابد ) پس افزایش غلظت موجب کاهش یافتن دمای انجماد ( ذوب ) می شود. [ ۲] [ ۳]

wiki: خواص کولیگاتیو
