در الکتروشیمی معادله نرنست معادله ای است که به کمک آن می توان دترمینان کاهش پتانسیل در حالت تعادل و در سلول الکتروشیمیایی بدست آورد و می توان از روی ولتاژ ( نیروی محرکه الکتریکی ) نیز همین کار را انجام داد. این نام به افتخار کاشف این فرمول به نام والتر نرنست است.
دو فرمول نهایی ( نیم پیل، پیل ) :
• پتانسیل تقلیل نیم - سلول:
• پتانسیل سلول کامل:
که:
• E r e d {\displaystyle E_{red}} پتانسیل کاهشی نیم پیل
• E r e d 0 {\displaystyle E_{red}^{0}} پتانسیل الکترود استاندارد
• E c e l l {\displaystyle E_{cell}} پتانسیل سلول ( نیروی محرکه الکتریکی )
• E c e l l 0 {\displaystyle E_{cell}^{0}} پتانسیل استاندارد سلول
• R ثابت عمومی گازها ( ۸٫۳۱۴۴۷۲ J. K - ۱. mol - ۱ )
• T دمای مطلق. ( TK = ۲۷۳٫۱۵ + T°C. )
• a میزان فعالیت شیمیایی. a X = γ X {\displaystyle a_{X}=\gamma _{X}} که γ X {\displaystyle \gamma _{X}} ضریب فعالیت نوع X است. ( درحالی که ضرایب فعالیت با غلظت پایین به یک میل می کنند، فعالیت ها در معادله نرنست متناوباً با غلظت ساده جایگزین می شوند )
• F ثابت فارادی ( اندازه بار بر مول الکترون، برابر با ۹٫۶۴۸۵۳۰۹×۱۰۴ C. mol - ۱ )
• z تعداد الکترون هایی است که در جریان برقکافت واکنش می دهند
• Q خارج قسمت واکنش است.
در دمای اتاق ( ۲۵ °C ) , RT/F برای پایانه ها ثابت ۲۵٫۶۷۹mV می توان جایگزین نمود.
معادله نرنست در فیزیولوژی برای پیدا کردن پتانسیل الکتریکی غشاء سلولی برحسب به یک نوع یون استفاده می شود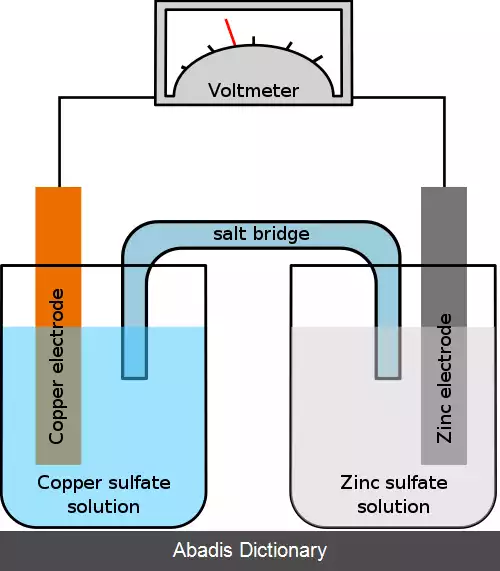
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدو فرمول نهایی ( نیم پیل، پیل ) :
• پتانسیل تقلیل نیم - سلول:
• پتانسیل سلول کامل:
که:
• E r e d {\displaystyle E_{red}} پتانسیل کاهشی نیم پیل
• E r e d 0 {\displaystyle E_{red}^{0}} پتانسیل الکترود استاندارد
• E c e l l {\displaystyle E_{cell}} پتانسیل سلول ( نیروی محرکه الکتریکی )
• E c e l l 0 {\displaystyle E_{cell}^{0}} پتانسیل استاندارد سلول
• R ثابت عمومی گازها ( ۸٫۳۱۴۴۷۲ J. K - ۱. mol - ۱ )
• T دمای مطلق. ( TK = ۲۷۳٫۱۵ + T°C. )
• a میزان فعالیت شیمیایی. a X = γ X {\displaystyle a_{X}=\gamma _{X}} که γ X {\displaystyle \gamma _{X}} ضریب فعالیت نوع X است. ( درحالی که ضرایب فعالیت با غلظت پایین به یک میل می کنند، فعالیت ها در معادله نرنست متناوباً با غلظت ساده جایگزین می شوند )
• F ثابت فارادی ( اندازه بار بر مول الکترون، برابر با ۹٫۶۴۸۵۳۰۹×۱۰۴ C. mol - ۱ )
• z تعداد الکترون هایی است که در جریان برقکافت واکنش می دهند
• Q خارج قسمت واکنش است.
در دمای اتاق ( ۲۵ °C ) , RT/F برای پایانه ها ثابت ۲۵٫۶۷۹mV می توان جایگزین نمود.
معادله نرنست در فیزیولوژی برای پیدا کردن پتانسیل الکتریکی غشاء سلولی برحسب به یک نوع یون استفاده می شود

wiki: معادله نرنست
