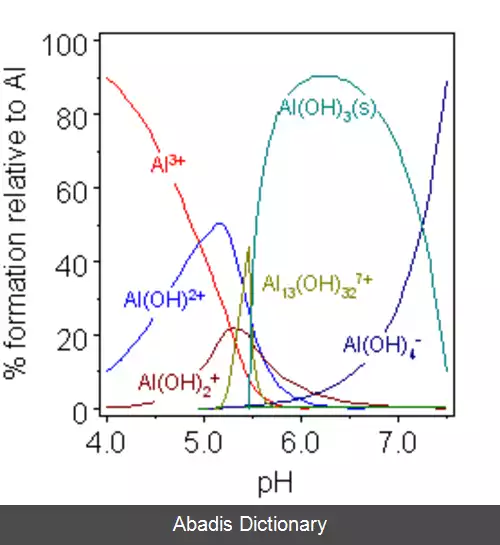
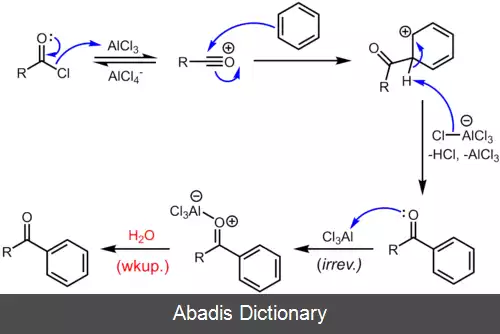
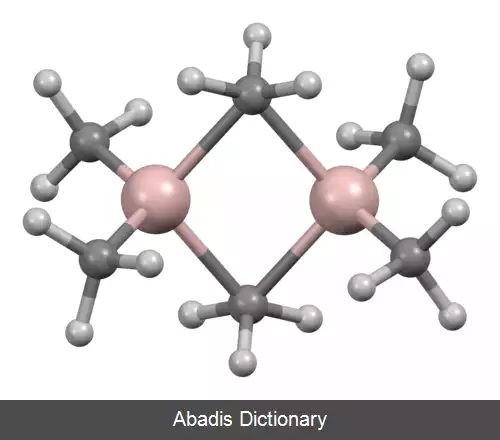
ترکیبات آلومینیوم. آلومینیوم ترکیبی از ویژگی های فلزات قبل و بعد از فلزات واسطه را دارد. از آنجایی که الکترون های کمی برای پیوند فلزی دارد، مانند فلزهای سنگین تر مشابه خود در گروه ۱۳، ویژگی های فیزیکی یک فلز بعد از فلزات واسطه، با فواصل بین اتمی طولانی تر از حد انتظار را دارد. [ ۱] علاوه بر این، از آنجایی که Al 3+ یک کاتیون کوچک و با بار زیاد است، به شدت قطبی است و ترکیبات آلومینیوم بیشتر خواص کووالانسی دارند. [ ۲] این رفتار شبیه رفتار بریلیم است ( Be 2+ ) ، نمونه ای از یک رابطه مورب. [ ۳] با این حال، بر خلاف سایر فلزات پس از فلزات واسطه، هسته زیرین زیر پوسته ظرفیتی آلومینیوم، هسته گاز نجیب سری قبلی جدول است، در حالی که برای گالیم و ایندیم، هسته گاز نجیب قبلی به اضافه یک زیر پوسته d پر شده است. برای تالیم و نیهونیوم هسته گاز نجیب قبلی به اضافه یک زیر پوسته های d و f پر شده است. از این رو، آلومینیوم دارای اثرات محافظت ناقص الکترون های ظرفیتی به وسیله الکترون های درونی هسته که فلزات سنگیت تر مشابه آن این خاصیت را دارند، ندارد. رفتارهای الکترومثبت آلومینیوم، میل ترکیبی بالا برای اکسیژن، و پتانسیل الکترود استاندارد بسیار منفی، اکثراً شبیه رفتارهای اسکاندیم، ایتریم، لانتانیم و اکتینیم هستند که از سه الکترون ظرفیت خارج از یک هسته گاز نجیب دارای پیکربندی ds2 هستند: در بین این فلزات آلومینیوم بیشترین فلز الکترو مثبت در این گروه هست. [ ۱] آلومینیوم همچنین شباهت های جزئی به بور متالوئیدی در گروه مشابه خود دارد. ترکیبات AlX3 دارای ظرفیت ایزوالکترونیک نسبت به ترکیبات BX3 هستند. ( آنها ساختار الکترونیک های ظرفیتی یکسانی دارند ) و هر دوی آن ها مانند اسیدهای لوئیس رفتار می کنند و به آسانی ترکیبات اضافی تشکیل می دهند؛[ ۴] علاوه بر این، یکی از نقوش اصلی شیمی بور ، ساختارهای ایکو وجهی منظم است و آلومینیوم بخش مهمی از بسیاری از آلیاژهای شبه کریستال ایکو وجهی، از جمله کلاس Al - Zn - Mg را تشکیل می دهد. [ ۵]
آلومینیوم با نافلزات تحت دمای بالا واکنش نشان می دهد که در نتیجه ترکیباتی مانند نیترید آلومینیوم ( AlN ) ، سولفید آلومینیوم ( Al2S3 ) ، و هالیدهای آلومینیوم ( ALX3 ) . همچنین طیف وسیعی از ترکیبات بین فلزی شامل فلزاتی از هر گروه جدول تناوبی را تشکیل می دهد. آلومینیوم دارای میل شیمیایی بالایی به اکسیژن است که آن را برای استفاده به عنوان یک عامل کاهنده در واکنش ترمایت مناسب می کند. پودرهای ریز فلز آلومینیوم در تماس با اکسیژن مایع واکنش انفجاری می دهند. با این حال، در شرایط عادی، آلومینیوم یک لایه اکسید نازک تشکیل می دهد که از فلز در برابر خوردگی بیشتر به وسیله اکسیژن، آب یا اسید رقیق محافظت می کند. به این فرایند غیرفعال سازی می گویند. [ ۲] این لایه در تماس با جیوه به علت ادغام شدن یا در تماس با نمک برخی از فلزات با الکترونگاتیویتی مثبت از بین می رود. [ ۲] به این ترتیب، قوی ترین آلیاژهای آلومینیوم به دلیل واکنش های گالوانیکی ای که با مس آلیاژی می دهند مقاومت به خوردگی پایین تری دارند، همچنین مقاومت به خوردگی آلومینیوم توسط نمک های آبی، به ویژه در حضور فلزات غیرمشابه، بسیار کاهش می یابد. [ ۱] علاوه بر این، اگر چه واکنش آلومینیوم با آب در دمای کمتر از ۲۸۰ درجه سانتیگراد برای تولید هیدروژن مورد توجه است، کاربرد تجاری این واقعیت در دور زدن لایه اکسید غیرفعال که واکنش را مهار می کند و در ذخیره انرژی مورد نیاز برای بازسازی فلز آلومینیوم چالش هایی دارد. [ ۶]
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفآلومینیوم با نافلزات تحت دمای بالا واکنش نشان می دهد که در نتیجه ترکیباتی مانند نیترید آلومینیوم ( AlN ) ، سولفید آلومینیوم ( Al2S3 ) ، و هالیدهای آلومینیوم ( ALX3 ) . همچنین طیف وسیعی از ترکیبات بین فلزی شامل فلزاتی از هر گروه جدول تناوبی را تشکیل می دهد. آلومینیوم دارای میل شیمیایی بالایی به اکسیژن است که آن را برای استفاده به عنوان یک عامل کاهنده در واکنش ترمایت مناسب می کند. پودرهای ریز فلز آلومینیوم در تماس با اکسیژن مایع واکنش انفجاری می دهند. با این حال، در شرایط عادی، آلومینیوم یک لایه اکسید نازک تشکیل می دهد که از فلز در برابر خوردگی بیشتر به وسیله اکسیژن، آب یا اسید رقیق محافظت می کند. به این فرایند غیرفعال سازی می گویند. [ ۲] این لایه در تماس با جیوه به علت ادغام شدن یا در تماس با نمک برخی از فلزات با الکترونگاتیویتی مثبت از بین می رود. [ ۲] به این ترتیب، قوی ترین آلیاژهای آلومینیوم به دلیل واکنش های گالوانیکی ای که با مس آلیاژی می دهند مقاومت به خوردگی پایین تری دارند، همچنین مقاومت به خوردگی آلومینیوم توسط نمک های آبی، به ویژه در حضور فلزات غیرمشابه، بسیار کاهش می یابد. [ ۱] علاوه بر این، اگر چه واکنش آلومینیوم با آب در دمای کمتر از ۲۸۰ درجه سانتیگراد برای تولید هیدروژن مورد توجه است، کاربرد تجاری این واقعیت در دور زدن لایه اکسید غیرفعال که واکنش را مهار می کند و در ذخیره انرژی مورد نیاز برای بازسازی فلز آلومینیوم چالش هایی دارد. [ ۶]




wiki: ترکیبات آلومینیوم
