سلول های ( پیل های ) الکتروشیمیایی فلز–هوا ( به انگلیسی: Metal–air electrochemical cell ) گونه ای از سلول های الکتروشیمیایی هستند که در آن از یک آند فلزی و یک کاتد بیرونی که در واقع همان هوای اطراف است و یک الکترولیت ( معمولاً آبی ) تشکیل شده است. باتری لیتیم–هوا و آلومینیم–هوا نمونه هایی از این نوع پیل ها هستند. [ ۱] [ ۲] یک سلول الکتروشیمیایی فلز هوا استفاده می کند از آندی که ساخته شده است از یک فلز خاص و یک کاتد خارجی از هوای محیط. نوعاً به صورت استفاده از الکترولیت آبی یا آلی هستند و در هنگام تخلیه یک سلول الکتروشیمیایی فلز - هوا یک واکنش کاهشی در کاتد هوای محیط رخ می دهد، هنگامی که آند فلزی اکسید می شود. ظرفیت مخصوص و چگالی انرژی یک سلول های الکتروشیمیایی فلز - هوا از باتری های لیتیم یون بیشتر است و آن ها را به عنوان یک گزینه برتر برای استفاده در وسایل نقلیه الکتریکی مطرح می کند. اگرچه عوارض مرتبط با آند فلزی، کاتالیست و الکترولیت مانع از توسعه و اجرای باتری های فلز - هوا می شود. هر چند برخی از آن ها کاربردهای تجاری هم دارند.
- 1 - باتری های لیتیوم - هوا
چگالی انرژی قابل توجه بالای فلز لیتیوم ( تا 3458 وات بر کیلوگرم ) از طراحی باتری های لیتیوم - هوا الهام گرفته است. یک باتری لیتیوم - هوا از یک الکترود جامد لیتیوم ، یک الکترولیت اطراف این الکترود و یک الکترود هوای محیط حاوی اکسیژن تشکیل شده است. باتری های لیتیوم - هوا را می توان بر اساس الکترولیت استفاده شده و ساختار سلول الکتروشیمیایی بعدی به چهار زیر مجموعه تقسیم کرد. این دسته های الکترولیت ها حالت آبزی، آبی، مخلوط آبی / غیر شگفت انگیز و حالت جامد هستند که همه مزایا و معایب مشخص خود را دارند. با این وجود، بازده باتری های لیتیوم - هوا هنوز با تخلیه ناقص در کاتد، شارژ بیش از حد پتانسیل تخلیه و پایداری جزء ، محدود می شود. در هنگام تخلیه باتری های لیتیوم - هوا، یون سوپراکسید ( O2− ) تشکیل شده با الکترولیت یا سایر اجزای سلول واکنش می دهد و از شارژ مجدد باتری جلوگیری می کند.
2 - 1 - باتری های سدیم - هوا
باتری های سدیم هوا با امید به غلبه بر بی ثباتی باتری مرتبط با سوپراکسید در باتری های لیتیوم هوا ارائه شده است. سدیم با تراکم انرژی 1605 وات بر کیلوگرم ، چگالی انرژی بالای لیتیوم را ندارد. با این حال، می تواند یک سوپراکسید پایدار ( NaO2 ) در مقابل سوپراکسید تحت واکنش های ثانویه مخرب تشکیل دهد. از آنجا که NaO2 برگشت پذیر است و تا حدی به اجزای اصلی تجزیه می شود ، این بدان معنی است که باتری های سدیم - هوا دارای ظرفیت ذاتی برای شارژ مجدد هستند. باتری های سدیم هوا فقط با الکترولیت های بی آب و بی آب می توانند کار کنند. هنگامی که یک الکترولیت DMSO با سدیم تری فلوئورومتان سولفونیمید تثبیت شد، بالاترین ثبات دوچرخه سواری باتری سدیم هوا ( 150 چرخه ) به دست آمد.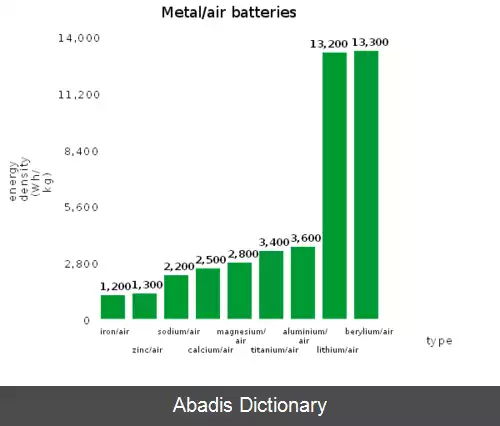
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلف- 1 - باتری های لیتیوم - هوا
چگالی انرژی قابل توجه بالای فلز لیتیوم ( تا 3458 وات بر کیلوگرم ) از طراحی باتری های لیتیوم - هوا الهام گرفته است. یک باتری لیتیوم - هوا از یک الکترود جامد لیتیوم ، یک الکترولیت اطراف این الکترود و یک الکترود هوای محیط حاوی اکسیژن تشکیل شده است. باتری های لیتیوم - هوا را می توان بر اساس الکترولیت استفاده شده و ساختار سلول الکتروشیمیایی بعدی به چهار زیر مجموعه تقسیم کرد. این دسته های الکترولیت ها حالت آبزی، آبی، مخلوط آبی / غیر شگفت انگیز و حالت جامد هستند که همه مزایا و معایب مشخص خود را دارند. با این وجود، بازده باتری های لیتیوم - هوا هنوز با تخلیه ناقص در کاتد، شارژ بیش از حد پتانسیل تخلیه و پایداری جزء ، محدود می شود. در هنگام تخلیه باتری های لیتیوم - هوا، یون سوپراکسید ( O2− ) تشکیل شده با الکترولیت یا سایر اجزای سلول واکنش می دهد و از شارژ مجدد باتری جلوگیری می کند.
2 - 1 - باتری های سدیم - هوا
باتری های سدیم هوا با امید به غلبه بر بی ثباتی باتری مرتبط با سوپراکسید در باتری های لیتیوم هوا ارائه شده است. سدیم با تراکم انرژی 1605 وات بر کیلوگرم ، چگالی انرژی بالای لیتیوم را ندارد. با این حال، می تواند یک سوپراکسید پایدار ( NaO2 ) در مقابل سوپراکسید تحت واکنش های ثانویه مخرب تشکیل دهد. از آنجا که NaO2 برگشت پذیر است و تا حدی به اجزای اصلی تجزیه می شود ، این بدان معنی است که باتری های سدیم - هوا دارای ظرفیت ذاتی برای شارژ مجدد هستند. باتری های سدیم هوا فقط با الکترولیت های بی آب و بی آب می توانند کار کنند. هنگامی که یک الکترولیت DMSO با سدیم تری فلوئورومتان سولفونیمید تثبیت شد، بالاترین ثبات دوچرخه سواری باتری سدیم هوا ( 150 چرخه ) به دست آمد.


