پروتئین فلورسنت سبز ( GFP ) پروتئینی متشکل از ۲۳۸ واحداسید آمینه ( ۲۶٫۹ کیلو دالتون ) است که هنگام قرار گرفتن در معرض نور در محدوده آبی تا فرابنفش ، فلورسانس ( فلوئورسنس ) سبز روشن از خود نشان می دهد. [ ۲] [ ۳] پروتئین های مشابهی که به رنگ سبز نیز فلورس ( شبرنگ ) می شوند، در بسیاری از موجودات دریایی یافت می شوند، اما برچسب GFP به طور سنتی به این پروتئین خاص اشاره دارد که ابتدا از چتر دریایی جدا شده و گاهی - در صورت لزوم چنین دقت - avGFP نامیده می شود.
GFP از A. victoria دارای یک قله یا اوج تحریک عمده در طول موج ۳۹۵ نانومترnm است و یک جزئی در ۴۷۵ نانومتر اوج انتشار آن در ۵۰۹ نانومتر است nm، که در قسمت فرو سبز طیف مرئی است. شاخص کوانتومی فلورسانس ( QY ) GFP 0. 79 است. GFP از دریاچه دریا ( Renilla reniformis ) دارای یک اوج تحریک عمده در ۴۹۸ است نانومتر GFP به دلیل توانایی تشکیل کروموفور داخلی بدون نیاز به کوفاکتورهای جانبی، محصولات ژنی یا آنزیم ها / بسترهای دیگر به غیر از اکسیژن مولکولی، ابزاری عالی در بسیاری از اشکال زیست شناسی محسوب می شود. [ ۴]
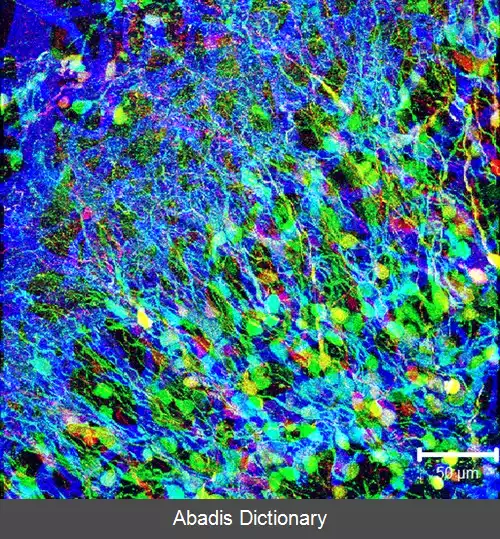
در زیست شناسی سلولی و مولکولی، ژن GFP اغلب به عنوان گزارشگر برای بیان ژن استفاده می شود. [ ۵] برای ایجاد حسگرهای زیستی از آن در اشکال اصلاح شده استفاده شده است و حیوانات بسیاری تولید شده اند که بیانگر GFP هستند، که اثبات این مفهوم را نشان می دهد که ژن می تواند در سراسر ارگانیسم معین، در اندام های منتخب یا سلول های مورد علاقه بیان شود. GFP می تواند از طریق تکنیک های تراریخته به حیوانات یا گونه های دیگر وارد شود و در ژنوم آنها و فرزندان آنها حفظ شود. تا به امروز، GFP در بسیاری از گونه ها، از جمله باکتری ها، مخمرها، قارچ ها، ماهی ها و پستانداران، از جمله در سلول های انسانی بیان شده است. دانشمندان راجر ی. تسین، اوسامو شیمومورا و مارتین چالفی به دلیل کشف و توسعه پروتئین فلورسنت سبز در ۱۰ اکتبر ۲۰۰۸ جایزه نوبل شیمی را دریافت کردند.
در دهه ۱۹۶۰ و ۱۹۷۰، GFP، همراه با پروتئین لومینسانس جداگانه اکورین ( آنزیمی که تجزیه لوسیفرین را تسهیل می کند و باعث آزاد شدن نور می شود ) ، ابتدا از چتر دریایی Aquorea victoria و خواص آن توسط اسامو شیمومورا بررسی شد. [ ۶] در A. ویکتوریا، فلورسانس GFP هنگامی رخ می دهد که اکورورین با یون های Ca2+ برهم کنش داشته و باعث درخشش آبی می شود. مقداری از این انرژی درخشان به GFP منتقل می شود و رنگ کلی را به سمت سبز تغییر می دهد. [ ۷] با این حال، کاربرد آن به عنوان ابزاری برای زیست شناسان مولکولی محقق نشد تا اینکه در سال ۱۹۹۲ که داگلاس پرشر ( Clouding ) و توالی نوکلئوتیدی wtGFP در ژن را گزارش کرد. [ ۸] بودجه این پروژه تمام شده بود، بنابراین Prasher نمونه های cDNA را به چندین آزمایشگاه ارسال کرد. آزمایشگاه مارتین چالفیه بیان برنامه نویسی توالی از wtGFP، با چند اسید آمینه حذف شده، در سلول های هترولوگ از باکتری E. coli و الگانس ، انتشار نتایج در علوم در سال 1994. [ ۹] آزمایشگاه فردریک تسوجی بیان پروتئین فلورسنت سبز نوترکیب را به طور مستقل یک ماه بعد گزارش داد. [ ۱۰] نکته قابل توجه این که، مولکول GFP بدون نیاز به کوفاکتورهای برون زای مخصوص شیرهای دریایی، در دمای اتاق فولد ( خمش مخصوص رشته اسیدهای آمینه که ساختار دوم و سوم پروتئین را می سازد ) و فلورسنت بود. اگرچه این پروتئین بسیار شبینه wtGFP فلورسنت بود، اما دارای اشکالات مختلفی بود، از جمله طیف تحریک دوگانه اوج، حساسیت به pH، حساسیت به کلراید، عملکرد کوانتومی فلورسانس ضعیف، قابلیت پایداری نوری و تا شدن ضعیف در ۳۷ درجه سانتیگراد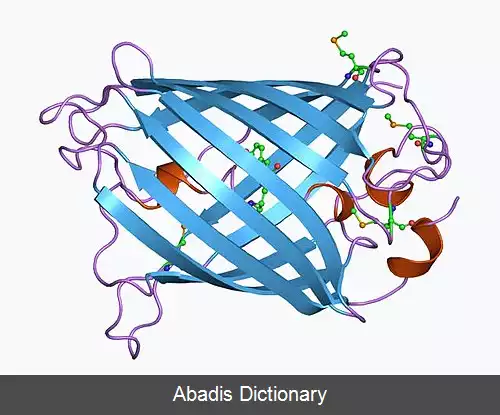


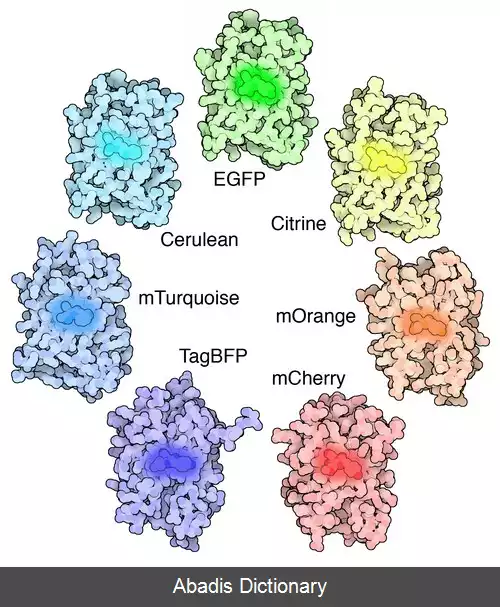

این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفGFP از A. victoria دارای یک قله یا اوج تحریک عمده در طول موج ۳۹۵ نانومترnm است و یک جزئی در ۴۷۵ نانومتر اوج انتشار آن در ۵۰۹ نانومتر است nm، که در قسمت فرو سبز طیف مرئی است. شاخص کوانتومی فلورسانس ( QY ) GFP 0. 79 است. GFP از دریاچه دریا ( Renilla reniformis ) دارای یک اوج تحریک عمده در ۴۹۸ است نانومتر GFP به دلیل توانایی تشکیل کروموفور داخلی بدون نیاز به کوفاکتورهای جانبی، محصولات ژنی یا آنزیم ها / بسترهای دیگر به غیر از اکسیژن مولکولی، ابزاری عالی در بسیاری از اشکال زیست شناسی محسوب می شود. [ ۴]
در زیست شناسی سلولی و مولکولی، ژن GFP اغلب به عنوان گزارشگر برای بیان ژن استفاده می شود. [ ۵] برای ایجاد حسگرهای زیستی از آن در اشکال اصلاح شده استفاده شده است و حیوانات بسیاری تولید شده اند که بیانگر GFP هستند، که اثبات این مفهوم را نشان می دهد که ژن می تواند در سراسر ارگانیسم معین، در اندام های منتخب یا سلول های مورد علاقه بیان شود. GFP می تواند از طریق تکنیک های تراریخته به حیوانات یا گونه های دیگر وارد شود و در ژنوم آنها و فرزندان آنها حفظ شود. تا به امروز، GFP در بسیاری از گونه ها، از جمله باکتری ها، مخمرها، قارچ ها، ماهی ها و پستانداران، از جمله در سلول های انسانی بیان شده است. دانشمندان راجر ی. تسین، اوسامو شیمومورا و مارتین چالفی به دلیل کشف و توسعه پروتئین فلورسنت سبز در ۱۰ اکتبر ۲۰۰۸ جایزه نوبل شیمی را دریافت کردند.
در دهه ۱۹۶۰ و ۱۹۷۰، GFP، همراه با پروتئین لومینسانس جداگانه اکورین ( آنزیمی که تجزیه لوسیفرین را تسهیل می کند و باعث آزاد شدن نور می شود ) ، ابتدا از چتر دریایی Aquorea victoria و خواص آن توسط اسامو شیمومورا بررسی شد. [ ۶] در A. ویکتوریا، فلورسانس GFP هنگامی رخ می دهد که اکورورین با یون های Ca2+ برهم کنش داشته و باعث درخشش آبی می شود. مقداری از این انرژی درخشان به GFP منتقل می شود و رنگ کلی را به سمت سبز تغییر می دهد. [ ۷] با این حال، کاربرد آن به عنوان ابزاری برای زیست شناسان مولکولی محقق نشد تا اینکه در سال ۱۹۹۲ که داگلاس پرشر ( Clouding ) و توالی نوکلئوتیدی wtGFP در ژن را گزارش کرد. [ ۸] بودجه این پروژه تمام شده بود، بنابراین Prasher نمونه های cDNA را به چندین آزمایشگاه ارسال کرد. آزمایشگاه مارتین چالفیه بیان برنامه نویسی توالی از wtGFP، با چند اسید آمینه حذف شده، در سلول های هترولوگ از باکتری E. coli و الگانس ، انتشار نتایج در علوم در سال 1994. [ ۹] آزمایشگاه فردریک تسوجی بیان پروتئین فلورسنت سبز نوترکیب را به طور مستقل یک ماه بعد گزارش داد. [ ۱۰] نکته قابل توجه این که، مولکول GFP بدون نیاز به کوفاکتورهای برون زای مخصوص شیرهای دریایی، در دمای اتاق فولد ( خمش مخصوص رشته اسیدهای آمینه که ساختار دوم و سوم پروتئین را می سازد ) و فلورسنت بود. اگرچه این پروتئین بسیار شبینه wtGFP فلورسنت بود، اما دارای اشکالات مختلفی بود، از جمله طیف تحریک دوگانه اوج، حساسیت به pH، حساسیت به کلراید، عملکرد کوانتومی فلورسانس ضعیف، قابلیت پایداری نوری و تا شدن ضعیف در ۳۷ درجه سانتیگراد






wiki: پروتئین فلورسنت سبز
