مولکولاریته در مطالعه سینتیک شیمیایی به تعداد مولکول هایی که در یک واکنش ابتدایی ( تک مرحله ای ) با یکدیگر واکنش داده و محصول را پدیدمی آورند، گفته می شود. [ ۱] و برابر است با مجموع ضرایب استوکیومتری واکنش دهنده ها با برخورد مؤثر ( انرژی کافی ) و جهت گیری صحیح در یک واکنش ابتدایی. [ ۲] بسته به اینکه چند مولکول به هم می پیوندند، یک واکنش می تواند تک مولکولی، دومولکولی یا حتی سه مولکولی باشد.
در یک واکنش تک مولکولی، یک مولکول منفرد با بازآرایی اتمی، مولکول های مختلف را تشکیل می دهد. [ ۱] این فرایند را با معادله زیر نشان می دهیم:
که در آن P به معنی محصول ( ها ) است. اگر فقط یک مولکول در محصول پدید بیاید، واکنش ایزومری شدن رخ داده است و اگر بیش از یک مولکول در محصول پدید بیاید، تفکیک رخ داده است.
در هر صورت، سرعت واکنش یا مرحله واکنش توسط قانون سرعت مرتبه اول توصیف می شود:
که در آن غلظت گونه A است، t زمان و kr ثابت سرعت واکنش است.
همان طور که از معادله قانون سرعت استنباط می شود، تعداد مولکول های A که از بین می روند با تعداد مولکول های A موجود متناسب است. مثالی از یک واکنش تک مولکولی، ایزومری شدن سیکلوپروپان به پروپن است:
واکنش های تک مولکولی را می توان با سازوکار سازوکار لیندمان توضیح داد.
در یک واکنش دومولکولی، دو مولکول با هم برخورد می کنند و انرژی بین اتم ها یا گروه های اتمی رد و بدل می شود. [ ۱]
این فرایند را می توان با معادله زیر توصیف کرد:
که مربوط به قانون سرعت مرتبه دوم است:
در اینجا، سرعت واکنش متناسب با جمع سرعت واکنش دهنده ها است. مثالی از یک واکنش دومولکولی جانشینی هسته دوستی از نوع SN2 در متیل بروماید توسط یون هیدروکسید است:[ ۳]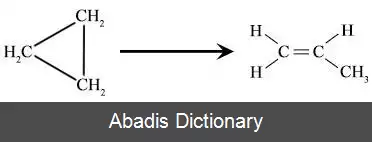
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر یک واکنش تک مولکولی، یک مولکول منفرد با بازآرایی اتمی، مولکول های مختلف را تشکیل می دهد. [ ۱] این فرایند را با معادله زیر نشان می دهیم:
که در آن P به معنی محصول ( ها ) است. اگر فقط یک مولکول در محصول پدید بیاید، واکنش ایزومری شدن رخ داده است و اگر بیش از یک مولکول در محصول پدید بیاید، تفکیک رخ داده است.
در هر صورت، سرعت واکنش یا مرحله واکنش توسط قانون سرعت مرتبه اول توصیف می شود:
که در آن غلظت گونه A است، t زمان و kr ثابت سرعت واکنش است.
همان طور که از معادله قانون سرعت استنباط می شود، تعداد مولکول های A که از بین می روند با تعداد مولکول های A موجود متناسب است. مثالی از یک واکنش تک مولکولی، ایزومری شدن سیکلوپروپان به پروپن است:
واکنش های تک مولکولی را می توان با سازوکار سازوکار لیندمان توضیح داد.
در یک واکنش دومولکولی، دو مولکول با هم برخورد می کنند و انرژی بین اتم ها یا گروه های اتمی رد و بدل می شود. [ ۱]
این فرایند را می توان با معادله زیر توصیف کرد:
که مربوط به قانون سرعت مرتبه دوم است:
در اینجا، سرعت واکنش متناسب با جمع سرعت واکنش دهنده ها است. مثالی از یک واکنش دومولکولی جانشینی هسته دوستی از نوع SN2 در متیل بروماید توسط یون هیدروکسید است:[ ۳]

wiki: مولکولاریته
